我国消化道恶性肿瘤高发,胃癌、结直肠癌发病率和死亡率位居恶性肿瘤前列。Notch信号通路对肠道发育及稳态的调控尤为关键,但其对下游基因表达的调控牵涉甚广,和多种通路存在复杂互作,机制尚未阐明。如何探究Notch信号通路与消化道肿瘤发生的关联机制,亟需建立新的研究策略。
2021年, 清华大学医学院倪建泉课题组、自动化系李梢课题组及同济大学孙方霖课题组在《EMBO Reports》杂志上合作发表了题为“HP1cregulates development and gut homeostasis by suppressing Notch signalingthrough Su(H)”的研究论文,发现果蝇异染色质蛋白HP1c(heterochromatinprotein 1c)通过与转录因子Su(H)相互作用来抑制Notch信号通路,从而调控肠道发育和维持稳态的新机制。
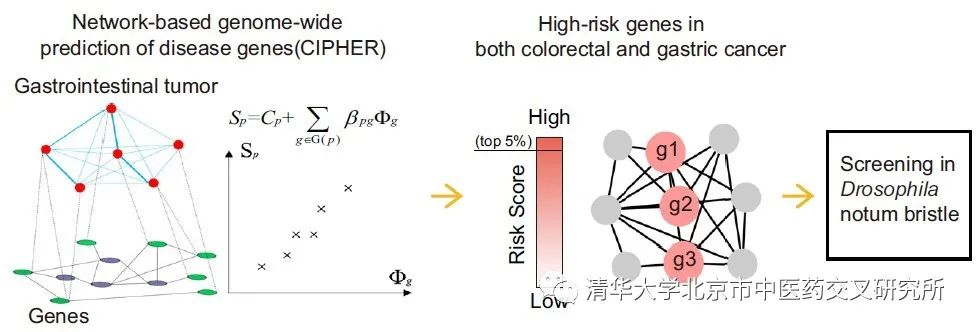
异染色质蛋白HP1c属于HP1蛋白家族,为高度保守的表观因子(epigenetic factor)。基于其在基因组水平上分布的广泛性及其与锌指蛋白WOC等的亲和性,HP1c被认为是潜在的、调控多基因表达的表观因子。该文提出智能计算预测和模式生物高通量实验相结合的系统性研究策略,聚焦于HP1c对Notch信号通路下游基因的调控及其对消化道恶性肿瘤发生发展的影响,在转基因干扰果蝇模型中发现并验证了高度保守的HP1c对Notch信号通路的直接调控作用,为从生物分子网络调控角度研究Notch信号通路与消化道肿瘤发生的关联机制提供了新途径。
该研究首先利用李梢课题组自主研制的、基于生物网络的致病基因预测方法,在全基因组范围内进行人类结直肠癌与胃癌相关基因的预测,获得高度保守的高风险基因。果蝇基因与人类大多数基因存在功能保守性,适合于进行大规模的基因表达调控和表型筛选,也是测试中药等药物药效毒理的理想动物模型之一。果蝇中肠存在一定数量的肠道干细胞,在Notch、JAK/STAT、EGFR等关键通路的调控下不断自我更新并分化,维持了果蝇肠道内的稳态。将智能计算结果整合清华果蝇中心转基因果蝇进行组织特异性分析,发现部分计算预测的高风险基因参与调控Notch信号相关表型。在肠道干细胞中敲低或敲除HP1c,发现可以促进肠道干细胞分化, 减少干细胞数量, 这与Notch激活表型一致。过表达HP1c,产生肠道肿瘤,与Notch抑制表型一致。同时,抑制Notch基因表达也可挽救HP1c敲低所导致的肠道发育缺陷,且表达人的同源蛋白HP1γ,可以显著挽救因HP1c敲低而产生的表型,验证了HP1c在果蝇和人类中的功能保守性,明确了HP1c参与消化道干细胞稳态,以及与Notch信号通路存在遗传互作。
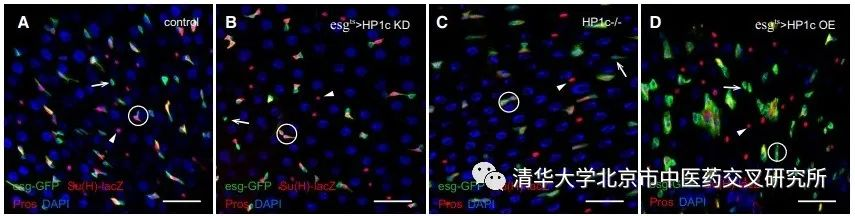
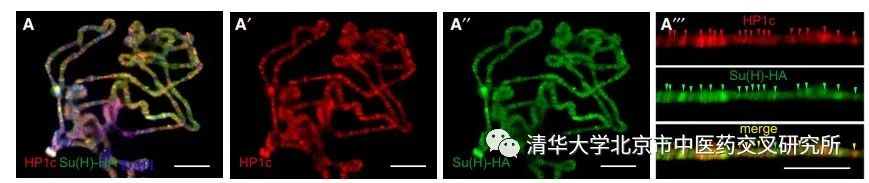
通过生化和分子生物学手段,课题组进一步挖掘分子机制。通过酵母双杂交和免疫共沉淀实验,发现HP1c与Notch信号通路中的关键转录因子Su(H)存在特异性相互作用。另一方面,免疫荧光实验也揭示HP1c与Su(H)在染色体上存在共定位现象,进一步证明它们的相互作用。
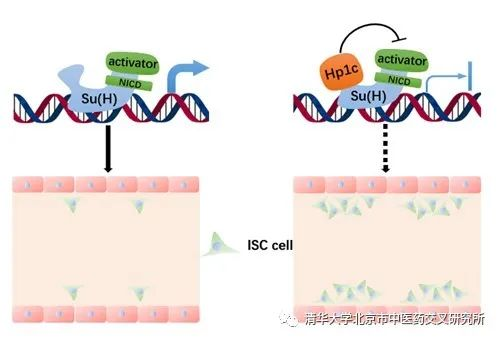
基于上述研究,课题组得出了如下模型:HP1c通过结合Notch信号通路转录因子Su(H),抑制其对Notch通路下游基因的激活,构成Notch信号通路的反馈调节闭环,进而调控果蝇肠道干细胞的分化。课题组通过计算预测和实验验证揭示了Notch信号通路与HP1c蛋白的互作机制,为研究肿瘤发生、信号通路与表观调控之间的关联机制提供了范例。
该文建立了基于“智能计算—协同调控”的研究新策略,获得生物学新发现,为消化道肿瘤发生发展的网络调控机制研究提供了一条新途径,也为基于多靶点网络调控的消化道肿瘤防治中药筛选提供了新手段。医学院孙锦博士、自动化系王鑫博士等为共同第一作者,清华大学医学院倪建泉研究员、自动化系李梢教授、同济大学孙方霖教授为共同通讯作者,参与作者还有清华大学常智杰、王钊、刘清飞等。本项目得到科技部和国家自然科学基金项目的支持。
论文出处:https://www.embopress.org/doi/full/10.15252/embr.202051298